Авторы:
Радциг Е.Ю.1, Гуров А.В.2
1РНИМУ им. Н.И. Пирогова Минздрава России, Москва, Россия
2ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» МЗ РФ, Москва
Боль в горле, развивающаяся в результате инфекционного воспаления верхних дыхательных путей, служит одним из наиболее частых поводов обращения пациентов всех возрастов к специалистам амбулаторного звена, включая оториноларингологические, терапевтические, педиатрические службы, а также семейных врачей и врачей общей практики. Наиболее часто данный симптом возникает при острых респираторных инфекциях (ОРВИ, ОРЗ, назофарингит, ларингофарингит), а также на фоне изолированного поражения глотки (фарингит, тонзиллит, тонзиллофарингит) [1–3].
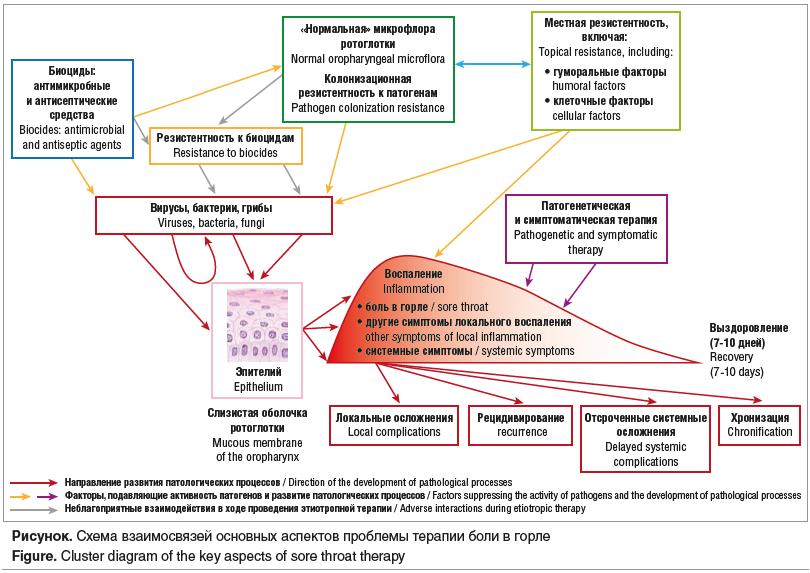
Актуальность проблемы терапии состояний, сопровождающихся болью в горле, помимо значительной распространенности самих заболеваний, определяется еще рядом аспектов (см. рисунок). Так, несмотря на особенности этиологии, которые кратко будут обсуждаться ниже, боль в горле на протяжении многих десятков лет является одним из самых частых поводов для назначения системных антибактериальных препаратов в качестве базисной терапии [4–6]. В свою очередь, высокая частота применения системных антибактериальных препаратов для лечения боли в горле во многом способствует дальнейшему росту антибиотикорезистентности [6, 7]. Наконец, значительное внимание в последние годы уделяется влиянию антибактериальной терапии на качественно-количественный состав микробиоты [8].
Этиология инфекционных заболеваний, сопровождающихся болью в горле
Среди этиологических факторов инфекционных заболеваний, сопровождающихся болью в горле, вне зависимости от возраста пациентов, доминируют респираторные вирусы (аденовирус, вирус Эпшейна — Барр, вирусы гриппа B и парагриппа, респираторно-синтициальный вирус, риновирус, бокавирус, метапневмовирус). У детей младше 3 лет частота воспалительных заболеваний глотки вирусной этиологии может достигать 80–90%, но по мере взросления возрастает доля «бактериального» генеза данного заболевания (24% в дошкольном возрасте против 52% в старшем школьном возрасте) [7, 9, 10]. По данным результатов исследований, проведенных в период пандемии COVID-19, вирус SARS-CoV-2 (штаммы дельта и омикрон) также может быть причиной возникновения боли в горле на фоне легкого течения инфекции [11].
Несмотря на то, что, по данным литературы, среди бактериальных возбудителей (особенно у детей от 3 лет и подростков до 15 лет) лидирующая роль по частоте и клинической значимости отводится Streptococcus pyogenes (β-гемолитический стрептококк группы А (БГСА)) [2, 7, 9], существуют работы, в которых исследователи демонстрируют меньшую значимость этого возбудителя в генезе острого тонзиллофарингита у педиатрических пациентов [10, 12].
По результатам исследований, нацеленных на выявление этиологической значимости других возбудителей, обсуждается возможная этиологическая роль гемолитических стрептококков групп С и G, Fusobacterium necrophorum, Arcanоbacterium haemolyticum, Mycoplasma pneumoniae, Chlamydophila pneumoniae [9, 13, 14].
Современные подходы к диагностике и лечению заболеваний, сопровождающихся болью в горле
В соответствии с современными отечественными и международными клиническими рекомендациями инфекции, вызываемые БГСА, требуют лечения с применением системных антибактериальных препаратов с целью предупреждения развития метатонзиллярных и системных осложнений. В настоящее время «золотым стандартом» для подтверждения стрептококковой этиологии заболевания являются экспресс-тесты, основанные на выявлении антигенов или ДНК возбудителя, хотя использование клинических шкал (Centor score, McIsaac score, FeverPain) также допускается. Следует подчеркнуть, что проведение экспресс-тестов не рекомендуется в возрастных категориях, для которых БГСА-этиология не является преобладающей (дети младше 3 лет, пациенты старше 50 лет). У детей старше 3–5 лет и подростков в сомнительных случаях (при расхождении результатов экспресс-диагностики с клиническими шкалами), а также в группах риска по развитию осложнений рекомендуется проведение классического бактериологического метода исследования [7, 9, 15].
С учетом сохраняющейся высокой чувствительности БГСА к β-лактамным антибиотикам, препаратами первой линии терапии являются пенициллины (предпочтительно применение амоксициллина). В случаях аллергии на препараты пенициллинов назначаются цефалоспорины, а при непереносимости всей β-лактамной группы — макролиды. Однако следует учитывать, что за последнее десятилетие отмечается существенный рост устойчивости БГСА к препаратам этой группы, а также к линкозамидам. Во всех остальных случаях абсолютное большинство клинических руководств рекомендуют проводить лишь симптоматическую терапию, направленную на купирование боли и других сопутствующих жалоб [2, 7, 9, 15]. Обсуждается применение топических препаратов, обладающих противовоспалительными свойствами, а также анестетиков и антисептиков [16, 17].
Среди причин для отказа от применения именно системных антибиотиков отмечаются риски формирования устойчивости, развития системных нежелательных явлений и отрицательного влияния на микробиоту макроорганизма. Для сокращения использования системных антибактериальных препаратов рекомендуется строгое следование клиническим руководствам (тщательная, последовательная клиническая и лабораторная диагностика) — так называемый «умный» выбор терапии, тактика отсроченного назначения препаратов. Кроме того, в ряде обзоров отмечается, что даже нелеченые случаи БГСА-фарингитов склонны к самоизлечению, и с учетом низкой частоты развития отсроченных осложнений обсуждается возможность отказа от применения системных антибактериальных препаратов у иммунокомпетентных пациентов [15].
Несмотря на активно предпринимаемые усилия, включая создание клинических руководств, различные образовательные проекты и контроль за назначениями, медицинское сообщество испытывает значительные затруднения в реализации стратегий снижения частоты использования системных противомикробных препаратов среди практикующих специалистов различных стран, в том числе стран Европы и Америки с высокоразвитыми системами здравоохранения [2, 4, 6, 18].
Согласно результатам проведенных исследований инфекционно-воспалительные заболевания, сопровождающиеся болью в горле, в значительной степени снижают качество жизни пациентов. Большинство обратившихся за медицинской помощью связывают более выраженную боль именно с развившейся инфекцией, что во многом определяет выбор врача в пользу этиотропной терапии [19].
При более тщательном изучении этиологического профиля с одновременной детекцией вирусных и бактериальных возбудителей очень часто выявляются вирусно-бактериальные ассоциации [3, 10, 11, 20]. Однако авторам не удалось найти публикации результатов исследований, в которых наряду с выявлением вирусных и/или бактериальных возбудителей одновременно проводилось бы комплексное исследование их этиологической значимости по классическим серологическим методикам. В то же время в клинической практике при обсуждении этиотропной терапии не учитывается классический тезис: вирусы открывают ворота очага воспаления для экспансии бактерий, а также тот факт, что в реальности на слизистой оболочке ротоглотки одновременно присутствуют и вирусные, и бактериальные патогены. Именно в отношении патогенеза острого фарингита/тонзиллофарингита логично допустить постепенный, не сразу обозначаемый клиническими маркерами переход преобладающей этиологической роли от вирусов к бактериям, что, возможно, и отражается данными исследований, одновременно выявляющих вирусное и бактериальное присутствие [10, 20, 21].
Наконец, авторы обращают внимание на сочетание двух важных тенденций. С одной стороны, желание уйти от повсеместного применения системных антибактериальных препаратов широкого спектра действия с целью снизить давление на микроорганизмы в целом и в первую очередь снизить агрессивное воздействие на региональные биотопы и микробиом пациента. Следует отметить при этом, что даже в странах с самым высоким уровнем здравоохранения применение узконаправленных антибиотиков потребует проведения значительного комплекса диагностических мероприятий в режиме, приближающемся к режиму реального времени, что в настоящее время является трудноосуществимой стратегией [8]. Вторая важная тенденция заключается в активном применении препаратов, обладающих способностью преодолевать основные механизмы формирования микробной устойчивости, что также может обеспечить снижение угрозы распространения антибиотикорезистентности [22].
Не вдаваясь в подробное описание самих механизмов реализации устойчивости бактерий к действию противомикробных средств, отметим, что в основе их развития можно выделить два принципиально важных направления: мутации в собственном геноме и приобретение генов резистентности посредством горизонтального переноса, в том числе через плазмиды. Двумя другими важнейшими аспектами устойчивости микроорганизмов к действию противомикробных препаратов являются уменьшение их метаболической активности, в частности переход в состояние персистеров, и формирование биопленок. Оценивая перспективы преодоления резистентности и толерантности, следует признать, что с эволюционной точки зрения создание средств, воздействующих на возбудителя инфекции при полном отсутствии риска формирования резистентности, крайне маловероятно. Более реалистичный подход — разработка препаратов, действующих одновременно на несколько мишеней в бактериальной клетке [23].
К таким препаратам относятся антимикробные пептиды, в частности наиболее подробно изученные и длительно применяемые антимикробные полипептиды (АМП) микробного происхождения [24]. Топическое применение АМП благодаря прямому попаданию в очаг воспаления в адекватной и безопасной концентрации позволяет в большей мере, чем системное введение антибактериальных препаратов, добиваться быстрой и полной эрадикации возбудителя, купирования воспаления и болевого синдрома. В отличие от классических антибактериальных препаратов АМП действуют одновременно на несколько мишеней, основной из которых является цитоплазматическая мембрана бактериальной клетки. Гибель микроорганизмов (достижение быстрого бактерицидного эффекта) происходит в очень короткие сроки, что обусловливает существенно более низкий риск формирования устойчивости патогенов.
В фокусе — АМП
Грамицидин С
Учитывая вышесказанное, АМП микробного происхождения в последнее время рассматриваются в качестве перспективных средств лечения инфекционных заболеваний в условиях высокого риска развития антибиотикорезистентности к системным препаратам [25]. Так, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) включило вещества из группы грамицидинов в список одобренных к применению против инфекций, вызванных грамположительными и грамотрицательными бактериями [24].
В отличие от линейных грамицидинов, открытых Рене Дюбо в составе противомикробных полипептидов (тиротрицин), продуцируемых бактерией Aneurinibacillus migulanus (прежнее название — Bacillus brevis) в 1939 г. [26], циклический декапептид грамицидин С (грамицидин советский, ГС) был выделен Г.Ф. Гаузе и М.Г. Бражниковой и описан в 40-х годах ХХ в. [27].
Молекула ГС является жестким кольцом, обладает амфифильными свойствами за счет наличия заряженной положительно (катионной) и гидрофобной частей. В состав молекулы ГС, синтезируемой нерибосомальным путем, входит в числе других аминокислот крайне редко встречающийся в составе природных белков и пептидов L-орнитин. Высокая стабильность молекулы в совокупности с наличием в составе неканонической аминокислоты позволяет ГС сохранять бактерицидное действие в широком диапазоне pH и избегать протеолитической деградации обычными протеазами микроорганизмов [28].
Благодаря своим свойствам ГС характеризуется выраженным многоцелевым бактерицидным действием в отношении широкого спектра грамположительных и грамотрицательных бактерий и некоторых дрожжевых грибов. ГС активен в отношении как планктонных форм микроорганизмов, включая клетки-персистеры, так и в отношении биопленок [28–30]. Согласно данным исследований, проведенных в рамках поиска перспективных препаратов против SARS-CoV-2, была выявлена способность ГС значительно снижать вирусную нагрузку в клетках Vero, инфицированных SARS-CoV-2, в эффективной концентрации 1,57 мкг/мл с сохранением максимальной эффективности до 24 ч. Кроме того, протеомный анализ показал, что в инфицированных клетках на фоне применения ГС нарушались регуляция и синтез белков, связанных с размножением вируса в клетках in vitro [31].
Основным способом реализации бактерицидного действия ГС является нарушение строения и функции липидного бислоя плазматической мембраны бактерий вплоть до образования значительных дефектов в высокой концентрации. За счет низкой молекулярной массы и особенностей строения молекулы ГС обладает, в отличие от других антимикробных пептидов, более высокой проницаемостью и быстро попадает внутрь клеток грамположительных и грамотрицательных микроорганизмов. Кроме того, ГС нарушает процессы клеточного дыхания и деления клеток широкого спектра патогенных бактерий [28, 32, 33].
Дополнительно показано, что одной из ключевых мишеней ГС могут являться молекулы (p)ppGpp (сигнальные молекулы стресса, которые инициируют и регулируют образование биопленок, переход клеток в персистирующее состояние и ряд других адаптационных реакций). Эта активность очевидно лежит в основе способности ГС эффективно ингибировать бактериальную стрессовую реакцию и препятствовать формированию биопленок, а также вызывать киллинг клеток-персистеров [28].
По механизму действия в целом ряде аспектов — влияние на биосинтез и целостность клеточной мембраны, изменение мембранного потенциала, делокализация белка MinD-GFP, активация быстрой потери калия, индукция белков-маркеров мембранного стресса LiaH и TrmB — ГС схож с низином (бактериоцин, продуцируемый стрептококками группы N, такими как Lactobacillus lactis), а также с рядом бактериоцинов I и II классов нормобиоты полости рта, в частности с циклическим бактериоцином 1B класса, вырабатываемым Lactobacillus acidophilus [34, 35]. В связи с такой функциональной близостью ГС может позитивно взаимодействовать не только с нормальной микрофлорой ротоглотки, но и с факторами местной неспецифической защиты [36].
Крайне высокая протеолитическая стабильность, а также множественные механизмы бактерицидного действия, включая выраженную мембранотропность, могут обусловливать практическое отсутствие случаев выявления у микроорганизмов приобретенной резистентности в отношении ГС в клинической практике вплоть до настоящего времени [24, 28, 37].
Полученные в условиях in vitro в ходе целенаправленного эксперимента с применением искусственной индукции, лабораторные штаммы Staphylococcus aureus 209P со сниженной чувствительностью к ГС сохраняли чувствительность к другим антибактериальным препаратам, но обладали пониженной на 30% дыхательной активностью и жизнеспособностью [38]. В отличие от ГС, в отношении других антимикробных пептидов, входящих в состав безрецептурных препаратов для лечения боли в горле (линейный грамицидин А, бацитрацин и тиротрицин), в ходе экспериментов по формированию устойчивости было продемонстрировано стабильно сохраняющееся после прекращения действия пептидов увеличение минимальной подавляющей концентрации (МПК) в отношении ряда микроорганизмов. Одновременно с возникновением устойчивости к данным пептидам у бактерий сформировалась приобретенная перекрестная устойчивость к классическим противомикробным препаратам (ципрофлоксацин, фузидиевая кислота, гентамицин, цефподоксим, амоксициллин / клавулановая кислота и цефотаксим) [39], что ставит вопрос о пересмотре перспективности этих пептидов в топической этиотропной терапии.
Согласно данным, опубликованным за последние 40 лет, показана высокая бактерицидная активность ГС в отношении грамотрицательных бактерий, включая Escherichia coli, Pseudomonas aeruginosa, Klebsiella pneumoniae и др., с МПК в диапазоне 4–64 мкг/мл. Более активен ГС в отношении грамположительных патогенных микроорганизмов. Например, МПК в отношении Staphylococcus aureus, включая штаммы, устойчивые к метициллину (MRSA), начиная с 1981 г. стабильно сохраняется на уровне, не превышающем 8 мкг/мл [40–42]. По данным S. Derbal et al. [43], ГС в концентрации <10 мкг/мл подавляет рост стрептококков (БГСА-штамм 5448 и ряд других стрептококков).
В проведенном с участием одного из авторов в октябре — декабре 2021 г. исследовании МПК ГС в отношении Staphylococcus aureus не превышала 8 мкг/мл, в том числе у клинических изолятов, характеризующихся множественной резистентностью в отношении нескольких групп классических антимикробных препаратов для системного действия (группы β-лактамов, макролидов, респираторных фторхинолонов, тетрациклинов, аминогликозидов и др.), что позволяет в очередной раз сделать вывод об отсутствии у данного патогена устойчивости к ГС [44]. Уровень МПК ГС в отношении всех тестовых патогенов не превышал концентрацию, содержащуюся в широко применяемых в клинической практике лекарственных препаратах (линия Граммидин®). МПК ГС в отношении Streptococcus pneumoniaе, включая штамм, резистентный к оксациллину и эритромицину, не превышала 16 мкг/мл.
Исследование показало, что различие между МПК и минимальной бактерицидной концентрацией (МБК, концентрация, вызывающая полную гибель бактериальных клеток) ГС в отношении исследуемых клинических изолятов патогенов не превышало 8 раз, что также отражает высокий потенциал бактерицидного действия.
Дополнительно проводили эксперимент, имевший задачей моделирование курсового воздействия ГС, приближенное к применению вещества в составе лекарственных препаратов в клинической практике (7-дневное применение в разовой дозе 1600–3200 мкг по 3–4 раза в сутки согласно инструкции по медицинскому применению препаратов линии Граммидин®). В данном эксперименте изучали влияние ГС на тестовые патогены в подавляющих и субподавляющих концентрациях (концентрации меньше МПК отражают реальные концентрации, создаваемые при клиническом применении в ротовой полости, а также используются в экспериментах по целенаправленному формированию резистентности микроорганизмов к противомикробным средствам в лабораторных условиях) на плотных и жидких средах. Результаты эксперимента показали, что при многократном ежедневном воздействии ГС на исследуемые микроорганизмы характеристики антимикробной активности ГС (МПК и МБК) не повышались на всем протяжении эксперимента (7 пассажей на плотных и жидких средах). Таким образом, результаты исследования продемонстрировали высокую бактерицидную активность ГС в отношении ведущих возбудителей респираторных инфекций, а в ходе многократного воздействия ГС на патогены, включая обладающие устойчивостью к широко применяемым системным антибиотикам и противомикробным средствам, не было выявлено признаков формирования у них резистентности [44].
Как указывалось выше, в случаях отсутствия показаний к системному назначению противомикробных препаратов в клинической практике широко применяется местная терапия, что нашло отражение в актуальных клинических рекомендациях [9]. Целью назначения местных препаратов являются подавление активности возбудителей инфекции, быстрое достижение противовоспалительного и болеутоляющего эффектов, а также профилактика вторичного инфицирования поврежденной слизистой оболочки глотки при благоприятном профиле безопасности препарата [9]. Вместе с тем в клинических рекомендациях отмечается наличие нежелательных эффектов и риска развития аллергических реакций, присущих некоторым из данных препаратов, например содержащим хлоргексидин и соединения йода [9]. Кроме того, не для всех местных противомикробных и антисептических средств понятны степень и характер их влияния на нормальную микробиоту, что является актуальным аспектом в настоящее время [9].
С учетом всех рассмотренных выше аспектов (широта спектра действия, выраженность терапевтического эффекта противомикробных препаратов, преодоление рисков развития антибиотикорезистентности, а также влияние на местные факторы защиты, включая нормальную микробиоту ротоглотки) наибольшую эффективность при применении топических препаратов можно достичь благодаря комбинированному воздействию нескольких синергично действующих компонентов [45]. Так, помимо топического применения антимикробных пептидов, перспективным может считаться местное использование препаратов, обладающих антисептическими свойствами, которое обеспечит более устойчивое воздействие на широкий спектр возбудителей заболевания [9].
Цетилпиридиния хлорид
К антисептическим средствам, разрешенным для топического применения у детей и взрослых, относится цетилпиридиния хлорид (ЦПХ) — четвертичное аммониевое соединение, широко известное с 1946 г. [46]. В исследованиях in vitro и in vivo продемонстрированы безопасность и эффективность применения ЦПХ в полости рта и в глотке [35, 47]. Механизм действия ЦПХ основан на дезинтеграции липидных мембран грамположительных и грамотрицательных патогенных и условно-патогенных бактерий ротовой полости, таких как Staphylococcus aureus, включая MRSA, Streptococcus sanguinis, Pseudomonas aeruginosa, а также грибов Candida albicans и Aspergillus niger. Кроме того, ЦПХ препятствует созданию биопленок патогенной микробиоты в полости рта и глотке и проявляет высокую активность в отношении мультимикробных биопленок [48]. Лабораторные исследования влияния антисептиков на микробиоту показали, что ЦПХ оказывал наиболее щадящее воздействие на индигенные микроорганизмы (представители нормальной микробиоты) [49]. Клиническое исследование группы профессора J.R. Radford et al. [50] продемонстрировало отсутствие нарушений нормобиоты полости рта при применении 0,05% раствора ЦПХ 2 раза в день в течение 6 нед. у здоровых добровольцев. Помимо этого, согласно результатам исследований, опубликованных за последние 10 лет, ЦПХ проявляет противовирусную активность в отношении респираторных вирусов (вирусы гриппа А и B, парагриппа, респираторно-синцитиальный вирус, коронавирусы SARS-COV-2, MERS-CoV, MHV-A59 и HCoV-NL63) [47, 51, 52].
Комбинация грамицидина С и ЦПХ широко применяется в клинической практике в двух лекарственных формах для топической терапии боли в горле (линия препаратов Граммидин®). Эффективность и безопасность препаратов в форме спрея подтверждены у взрослых и детей в возрасте с 3 лет [35, 53] и в форме таблеток для рассасывания у детей в возрасте 4 года и старше [54, 55].
Известно, что вирусы, обладающие тропностью к эпителию слизистой оболочки носо- и ротоглотки, а также бактериальные патогены и вирусно-бактериальные ассоциации в процессе развития инфекционного воспаления приводят к выраженным изменениям нормобиоты — одного из важнейших физиологических барьеров и звеньев неспецифической резистентности организма человека в верхних отделах дыхательного и пищеварительного трактов [56].
Возвращаясь к одному из очень важных аспектов, затронутых в статье, следует отметить, что состав и функциональная активность нормальной микробиоты играют ключевую роль в функционировании системы местной резистентности. Нарушение колонизационной резистентности слизистой оболочки респираторного тракта в результате воздействия вирусных и бактериальных возбудителей респираторных инфекций приводит к более легкому развитию указанных инфекций, выраженному длительному и рецидивирующему характеру их течения [57]. В связи с этим при выборе препаратов для топической этиотропной терапии инфекционно-воспалительных заболеваний верхних дыхательных путей целесообразно использовать сценарий биоценозсберегающей терапии [58, 59].
Заключение
Проблема адекватной терапии острых инфекционно-воспалительных заболеваний верхних дыхательных путей, сопровождающихся болью в горле, остается актуальной, несмотря на многочисленные исследования, имеющиеся авторитетные клинические рекомендации и алгоритмы диагностики и терапии.
Актуальность этой темы определяется не только высокой распространенностью данной группы заболеваний среди населения практически всех возрастов — важнейшими аспектами являются выбор терапевтической стратегии с учетом потребностей пациентов, а также последствия антимикробной терапии в виде роста антибиотикорезистентности и снижения колонизационной резистентности слизистой оболочки с развитием дисбиотических изменений.
В настоящее время, с одной стороны, отмечается необоснованно широкое применение практикующими специалистами системных антибактериальных препаратов с указанными выше последствиями, с другой стороны, имеются отдаленные перспективы по внедрению системных узконаправленных противомикробных агентов и формированию по сути новой парадигмы противомикробной терапии в целом. Вместе с тем уже в настоящее время существует вполне реальная возможность решения имеющихся проблем — использование топических комбинированных препаратов, компоненты которых оказывают синергичное этиотропное действие и вместе с тем существенно снижают риск формирования устойчивости микроорганизмов при щадящем влиянии на функционирование нормальной микробиоты ротоглотки, которая является ключевым звеном системы резистентности организма человека.
Читать полную версию в источнике.